Cruciale FDA-goedkeuring voor ONWARD bij ruggenmergletsel
Het Nederlandse bedrijf heeft groen licht gekregen van de Amerikaanse FDA om zijn behandelingssysteem voor ruggenmergletsel te testen.
Published on August 20, 2025
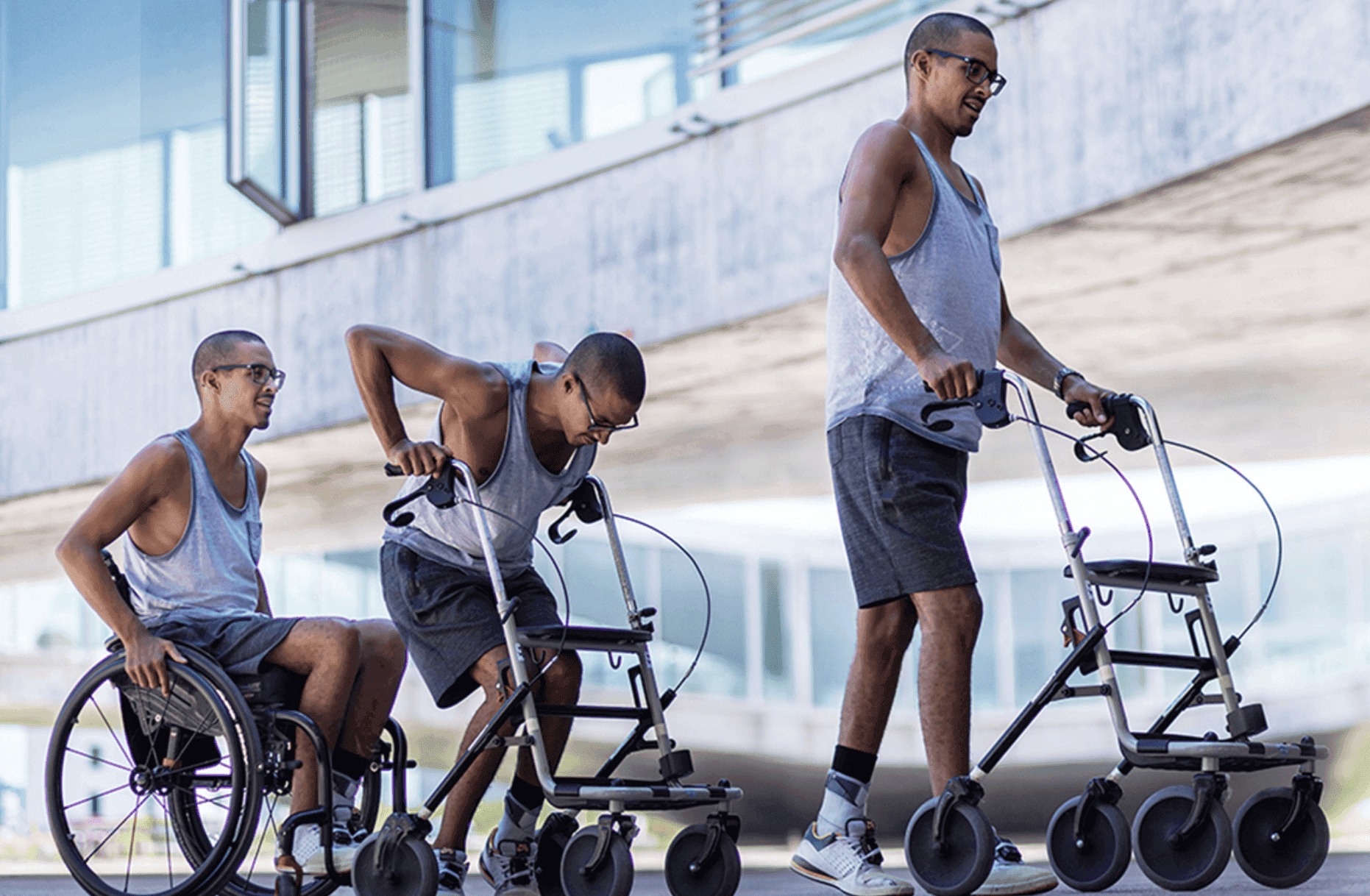
Team IO+ selecteert en brengt de belangrijkste nieuwsverhalen over innovatie en technologie, zorgvuldig samengesteld door onze redactie.
ONWARD Medical, een baanbrekend medisch technologiebedrijf, heeft goedkeuring gekregen van de Amerikaanse federale volksgezondheidsinstantie, de Food and Drug Administration (FDA), voor een klinische studie naar zijn ARC-IM-systeem. Dit implanteerbare neurostimulatieapparaat is ontworpen om bloeddrukinstabiliteit aan te pakken – een belangrijke onvervulde behoefte voor mensen met ruggenmergletsel. De Empower BP-studie, waarbij 20 toonaangevende onderzoekscentra betrokken zijn, zal naar verwachting voor het einde van 2025 beginnen met het werven van patiënten, wat een belangrijke mijlpaal betekent voor de gemeenschap van mensen met ruggenmergletsel (SCI).
Het in Eindhoven gevestigde ONWARD Medical loopt voorop in de ontwikkeling van innovatieve therapieën voor SCI-patiënten. Hun focus ligt onder meer op het herstellen van beweging en functie door middel van geavanceerde technologische oplossingen. Voortbouwend op meer dan tien jaar wetenschappelijk onderzoek, preklinisch onderzoek en klinische studies uitgevoerd in toonaangevende ziekenhuizen, revalidatieklinieken en neurowetenschappelijke laboratoria, heeft het bedrijf ARC Therapy ontwikkeld.
Het ARC-IM-systeem, dat zal worden getest in de door de FDA goedgekeurde pivotale studie, is speciaal ontworpen om de bloeddruk te stabiliseren bij personen die een dwarslaesie hebben opgelopen. Bloeddrukinstabiliteit is een veelvoorkomende en vaak over het hoofd geziene complicatie van dwarslaesie, die meer dan 50% van de personen met dwarslaesie treft, wat neerkomt op ongeveer 350.000 mensen in de VS en Europa. Deze aandoening heeft een aanzienlijke invloed op de cardiovasculaire gezondheid en de algehele kwaliteit van leven, waardoor effectieve behandeling een cruciale onvervulde behoefte is.
De Empower BP-pivotaalonderzoek
Dankzij de goedkeuring van de Investigational Device Exemption (IDE) van de FDA kan Onward Medical doorgaan met het Empower BP-pivotaalonderzoek. Dit wereldwijde, gerandomiseerde, dubbelblinde, sham-gecontroleerde onderzoek zal de veiligheid en werkzaamheid van het ARC-IM-systeem evalueren. Bij het onderzoek zullen ongeveer 20 toonaangevende onderzoekscentra voor neurorevalidatie en neurochirurgie in de Verenigde Staten, Canada en Europa betrokken zijn. De inschrijving van de eerste patiënten zal naar verwachting voor het einde van 2025 van start gaan.
“Bloeddrukinstabiliteit, met name chronische lage bloeddruk, is een van de meest verborgen en onderkende functionele complicaties van ruggenmergletsel”, legt dr. James Guest, neurochirurg en hoogleraar neurologische chirurgie aan de Universiteit van Miami, uit. “Het zorgt ervoor dat mensen zich onwel voelen en kan een aanzienlijke invloed hebben op hun algehele kwaliteit van leven. Bloeddrukinstabiliteit verhoogt ook het risico op hart- en vaatziekten, waardoor het aanpakken van deze onvervulde behoefte van cruciaal belang is voor het verbeteren van de langetermijnresultaten van SCI.”
“Dit is een belangrijke mijlpaal voor ONWARD en de SCI-gemeenschap”, aldus Dave Marver, ceo van ONWARD. “Ons ARC-IM-systeem is ontworpen om verschillende onvervulde behoeften aan te pakken, waaronder bloeddrukinstabiliteit, wat een belangrijk hersteldoel is na ruggenmergletsel. Met deze IDE-goedkeuring blijven we onze innovatiepijplijn verder ontwikkelen en realistische hoop geven op het herstel van autonome functies en onafhankelijkheid na SCI en andere bewegingsbeperkingen.”
